La cohésion
- Une attraction entre grains et eau :
L'apport d'eau fait perdre au sable ses propriétés de granuleux, le transforme: il se comporte alors comme une pâte à modeler, façonnable à volonté.
Ceci est l'effet de l’adhésion capillaire, un mécanisme physique permettant de maintenir en contact deux corps par l'intermédiaire d'un film mince de liquide.
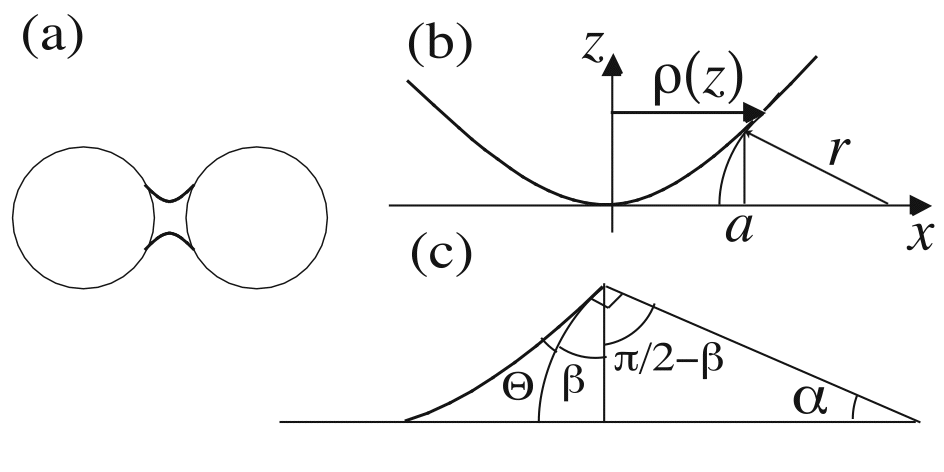
Il est par exemple visible entre deux billes de verre reliées par de l’eau:
Expérimentation* : youtu.be/ce6CVfKKBlE
La petite quantité d'eau présente entre deux billes, ou deux grains de sable permet alors une attraction entre eux: cette liaison est appelée pont capillaire.
Ce pont est courbé vers l’extérieur:

Le lien entre deux grains crée comme une force de succion suffisante pour suspendre l'un des grains à l'autre. C'est pourquoi quand on est mouillé si on touche du sable sec, les grains se collent à la peau et il est difficile de s'en débarrasser.
En ajoutant du liquide, les ponts s’étendent à l’ensemble du sable et forment des structures plus grandes. Les surfaces de chaque grain de sable entrent alors en contact avec davantage d'eau, ce qui tend à augmenter l'effet de cohésion. Ainsi, l’eau semble « attirer » les grains.
Mais, comment les ponts capillaires maintiennent-ils les grains entre eux ?
La structure solide formée de grains reliés par de l’eau est en réalité rendue possible par une force capillaire supérieure au poids des grains: ces derniers sont en conséquence retenus.

Cette force peut être calculée à partir de l’équation suivante:

 l’angle d’ouverture du ménisque ***
l’angle d’ouverture du ménisque ***
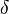 la hauteur du ménisque
la hauteur du ménisque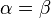 :
: 
Si cette force est supérieure au poids d'un grain de sable, elle est suffisante pour assurer l'adhésion des grains.
Un grain de sable a un rayon typique de ≈300µm, soit 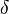 ≈ 10µm et
≈ 10µm et  ≈ 50µm
≈ 50µm
Alors 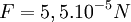
Soit V le volume d'un grain de sable et µ la masse volumique du sable, le poids d'un grain de sable est donné par P = µ*V*g ≈ 2*10^-6 N (en prenant une densité de 2 pour le sable).
Ainsi, si la force capillaire est supérieure à 2.10-6N, alors, la quantité d’eau utilisée empêche bien les grains de sable de se décoller.
Mais quelle est cette force d’attraction ?
- Des forces physiques de cohésion moléculaire :
Des forces d'attraction microscopiques, dites force de Van Der Waals, vont s'exercer entre d'une part les molécules d'eau entre elles et d'autre part les molécules d'eau et la surface de silice du grain de sable. Elles sont intenses à courte portée (distance inférieure au nanomètre, 10-9). L'eau va chercher le plus grand contact possible avec les grains et le plus petit possible avec l'air: d’où la forme de sablier du pont capillaire.
En effet, la silice ou dioxyde de silicium SiO2 est un des constituants principal du sable.
Le silicium a pour numéro atomique 14, d'où la structure électronique suivante(K)2(L)8(M)4 soit : 4 électrons liants et 0 non liants. Le silicium formera donc 4 liaison covalentes:
On en déduit la formule de Lewis de la molécule de dioxyde de silicium :
O = Si = O
De plus, la formule de Lewis de l'eau H2O est la suivante :

La molécule d'H2O est polaire tandis que celle de SiO2 est apolaire(les barycentres des charges coïncident).
En effet, dans ces structures, on observe que le silicium et les atomes d'hydrogène sont peu électronégatifs tandis que les atomes d'oxygène sont très électronégatifs.
Les atomes d'électronégativité opposées vont alors s'attirer, formant un dipôle électrique instantanné: le nuage électronique des atomes subissent une polarisation par influence.
 a-Apparition d'un dipôle instantanné au sein des molécules de SiO2 et d'H2O
a-Apparition d'un dipôle instantanné au sein des molécules de SiO2 et d'H2O
b-Représenation du dipôle instantané et de son moment dipolaire
Ainsi, une liaison attractive de Van Der Waals va se créer entre le Si du dioxyde de silicium et l'oxygène de la molécule d'eau tandis qu'une liaison hydrogène se forme entre l'oxygène du dioxyde de silicium et l'hydrogène de la molécule d'eau.


Il en est ainsi pour toutes les molécules constituant les grains où l’eau, qui interagissent, créant des dipôles instantanés: la cohésion des grains de sable et de l’eau est assurée.
Cependant, préférable à de l’eau douce, l’eau salée permet un meilleur maintien de la structure dans le temps. En effet, un pâté de sable constitué d’eau douce va s’effondrer au fur et à mesure que l’eau permettant la cohésion va s’évaporer.
Au contraire, l’eau de mer va permettre une cristallisation de la structure et ainsi son maintien après évaporation de l’eau: au fur et à mesure que l'eau va s'évaporer, des liens de sel vont prendre sa place, assurant la cohésion de l'édifice. Ces liens de sel vont eux aussi finir par se rompre, le château va alors se liquéfier: mais son espérance de vie aura malgré tout augmentée.
Ainsi, l’utilisation d’eau salée, par exemple de l’eau de mer, apparait préférable à celle d’eau douce.
- Le danger d’une surpression en eau :
Toutefois, comme observé lors de notre seconde expérience, une quantité d’eau trop importante provoque l’effondrement de la structure. L’importance des forces capillaires diminue en effet à mesure que la structure en pont s’étend: en effet, comme vu précédemment, la force de van der Walls est forte pour une distance minime entre deux éléments; dans le cas d’une grande quantité d’eau, les grains s’éloignent les uns des autres, du fait de la place important que prend l’eau dans leurs interstices.

Le phénomène de dilatance** est d’ailleurs alors observable.
Ainsi, afin de permettre une meilleure cohésion de la matière, les grains doivent être proches. D’où l’antique méthode de nos grands-mères, qui consiste à tapoter le moule contenant le sable: le rapprochement des grains et donc des molécules de SiO2 et d'H2O crée des intéractions plus fortes et plus nombreuses, permettant une meilleur résistance de la structure.
page suivante : ssb-tpe-scientificsandbuilder.webnode.fr/application-%C3%A0-une-structure-artificielle/
TPE 2015
